Belajar Teori Model Atom Mekanika Kuantum Modern
Sejarah dan Teori Model Atom Mekanika Kuantum Modern
Daerah di sekitar ruang inti dengan kebolehjadian untuk mendapatkan elektron adalah orbital. Lalu bentuk dan tingkat energi orbital dirumuskan oleh Erwin Schrodinger dan Erwin Schrodinger memecahkan suatu persamaan untuk mendapatkan fungsi gelombang untuk menggambarkan batas kemungkinan ditemukannya elektron dalam tiga dimensi.
Teori kuantum juga telah diungkapkan oleh Max Planck pada tahun 1900 yang menyatakan bahwa atom bisa memancarkan atau menyerap energi tapi hanya dalam jumlah tertentu (kuanta). Sedangkan Jumlah energi yang dipancarkan atau diserap dalam bentuk radiasi elektromagnetik itu disebut kuantum. Untuk besarnya kuantum dinyatakan dalam persamaan berikut:
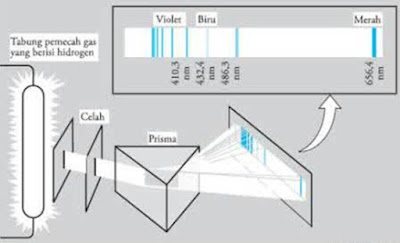
Dengan teori kuantum, kita bisa mengetahui besarnya radiasi yang dipancarkan maupun yang diserap. Selain itu, teori kuantum juga dapat digunakan untuk menjelaskan terjadinya proses spektrum atom. Perhatikan spektrum atom hidrogen berikut ini :
Pada Gambar di atas dapat kita lihat bahwa percikan listrik masuk kedalam tabung gelas yang didalamnya mengandung gas hidrogen. Sinar yang keluar dari atom H (setelah melalui celah) masuk kedalam prisma, sehingga terjadilah sinar tersebut terbagi menjadi beberapa sinar yang membentuk garis spektrum dan ketika sinar itu ditangkap oleh layar, empat garis yang panjang gelombangnya tertera pada layar adalah bagian yang bisa dilihat dari spektrum gas hidrogen.
Karakteristik model atom kuantum, antara lain :
- Gerakan padaelektron memiliki sifat gelombang, sehingga lintasannya (orbitnya) tidak sestasioner seperti model Bohr, akan tetapi mengikuti penyelesaian kuadrat fungsi gelombang yang disebut orbital (bentuk tiga dimensi darikebolehjadian paling besar ditemukannya elektron dengan keadaan tertentu dalam suatu atom)
- Bentuk dan ukuran orbital tergantung pada harga dari ketiga bilangan kuantumnya atau Elektron yang menempati orbital dinyatakan dalam bilangan kuantum tersebut.
- Posisi elektron pada jarak 0,529 Amstrong dari inti H menurut Bohr bukannya sesuatu yang pasti, tapi bolehjadi merupakan peluang terbesar ditemukannya elektron.
Bilangan kuantum dan orbital atom, antara lain :
- Schrodinger berhasil menyelesaikan seperangkat persamaan matematis yang menghasilkan bahwa tiga bilangan kuantum yang menunjukkan daerah kebolehjadian menemukan elektron di sekeliling inti atom.
- Ketiga bilangan kuantum itu ialah bilangan kuantum utama (n), bilangan kuantum azimut (l), dan bilangan kuantum magnetik (ml).
- Bilangan kuantum utama (n) menunjukkan tingkat energinya.
- Bilangan kuantum azimut (l) menentukan bentuk orbital dan sub tingkatan energinya.
- Bilangan kuantum magnetik (ml) menyatakan orientasi orbital atau sikap dari orbital terhadap orbital lain.
- Selain tiga bilangan kuantum yang berasal dari penyelesaian persamaan Schrodinger ternyata masih ada satu bilangan kuantum yaitu bilangan kuantum spin (ms).
- Bilangan kuantum spin (ms) menentukan arah perputaran (spin) tiap elektron.
Konfigurasi elektron dan sistem periodik :
- Menurut prinsip Aufbau, konfigurasi elektron dimulai dari subkulit yang memiliki tingkat energi terendah dan diikuti dengan subkulit yang memiliki tingkat energi tinggi.
- Asas larangan Pauli menyatakan bahwa tidak ada dua elektron dalam sebuah atom, apapun bisa mempunyai keempat bilangan kuantum yang sama.
- Menurut aturan Hund, dalam subtingkatan energi tertentu, setiap orbital itu dihuni oleh satu elektron terlebih dahulu sebelum ada orbital yang memiliki sepasang elektron. Elektron-elektron tunggal dalam orbital itu yang mempunyai spin searah (paralel).
- Dalam sistem periodik unsur, unsur dikelompokkan dalam empat blok, yaitu blok s, blok p, blok d, dan blok f.




Post a Comment for "Belajar Teori Model Atom Mekanika Kuantum Modern"